Con tautomería se hace referencia al proceso de reajuste rápido y reversible que sufre una molécula.Se aplica a una migración protónica intramolecular en forma reversible, se podría considerar como una reacción ácido-base sobre la misma molécula, en donde un lugar de la estructura sería el ácido (libera el protón), y otra parte de la estructura lo acepta, actuando como la base.
En el
caso de los aldehídos, si uno posee al menos un
átomo de hidrógeno en el átomo de carbono adyacente al grupo carbonilo (carbono
α), este hidrógeno puede migrar al átomo de oxígeno del grupo carbonilo. El
doble enlace luego migra al carbono α y como resultado, un compuesto carbonilo
con un α-hidrógeno puede existir en dos formas isoméricas, llamadas tautómeros.
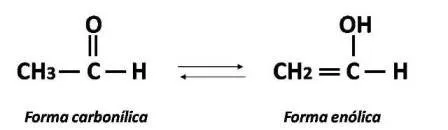
En la forma carbonílica, el hidrógeno está unido al carbono α, mientras que en la forma enol está unido al oxígeno carbonilo con la migración del doble enlace. El nombre enol se deriva de la designación IUPAC, el prefijo en se debe al doble enlace (un alqueno) y el –ol de un alcohol. Las formas carnonílica y enólica existen en equilibrio en el que ambos tautómeros están presentes pero, en casos simples, la forma carbonílica es mucho más estable que la forma enol. En el acetaldehído, por ejemplo, solo aproximadamente 6 de cada 10 millones de moléculas están en forma de enol en un momento dado. Sin embargo, el equilibrio siempre existe, y cada molécula de acetaldehído (así como cualquier otro aldehído o cetona con un α-hidrógeno) se convierte a la forma enol (y nuevamente) varias veces por segundo. Esta es una característica importante porque varias reacciones de los compuestos carbonílicos tienen lugar solo a través de las formas enol. Sin embargo, ciertos compuestos carbonílicos tienen un porcentaje mucho mayor de sus moléculas en forma de enol.
Lo que
ocurre es que la cantidad de cada forma depende de la estabilidad relativa de
ambos tautómeros, siendo afectada por la capacidad que tengan para
formar puentes de hidrógeno, una posible conjugación de los dobles enlaces o la
formación de un puente de hidrógeno intramolecular que desplaza el equilibrio
hacia la forma enólica.
Generalmente se utiliza la constante de equilibrio, que recibe el nombre de constante tautomerica, kt, para analizar la estabilidad del compuesto. Así, a mayor valor de la constante el compuesto será más estable. Veámoslo con el siguiente ejemplo:
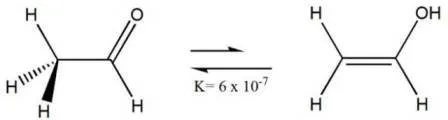
Tautomería ceto-enol del acetaldehído. Fuente: wikipedia.com
El
valor de la constante tautomérica Kt = 6*10-7, nos indica
que el compuesto en la forma carbonílica está en mayor proporción, lo que puede
significar una mayor estabilidad para la estructura (menor energía).
Por
otro lado, en el siguiente ejemplo la constante tautomérica es demasiado
grande, Kt > 1.
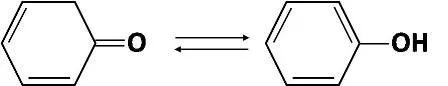
Lo que implica, que la forma enólica será la que se encentre en mayor proporción, lo que este caso puede significar, una mayor estabilidad de la estructura del fenol.
La tautomería constituye en cierto modo una
contrafigura de la isomería. En esta aparecen varios compuestos diferentes
cuando, por su composición, debería esperarse uno solo. Por el contario, en que
aquella, por las posibilidades de isomería debemos esperar la existencia de dos
compuestos, encontramos solamente uno
Referencias
Enciclopedia Británica. Tautomerism
Wikipedia.com. Tautomería
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2019/03/tautomeria-de-aldehidos